|
|||||
|
规则二:
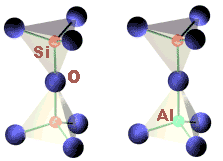
在一个稳定的晶体结构中,从所有相邻接的阳离子到达一个阴离子的静电键强总和等于阴离子的电荷。静电键强=(阳离子电荷/阳离子的配位数)。在硅酸盐中,Si与O形成四面体配位,Si-O键强=1,在四面体共角顶处的O形成两个Si-O键,键强总和为2,恰好等于O的电荷数。所以[SiO]四面体共角顶相连形成的晶体结构是稳定的。 如果将一个四面体中的Si换成Al,总键强=1+3/4=1.75,小于O离子的电荷数,结构变得不太稳定,需要其他阳离子来平衡电荷。如果将两个四面体中的Si都换成Al,总键强=3/4 +3/4=1.5,结构变得十分不稳定。所以在晶体中[AlO]四面体,一般不能共角顶相连。
|
|||||